心房細動の遺伝的基盤を解明 -大規模ゲノムデータによる病態解明と遺伝的リスクスコア構築-
- ヘッドライン
- 記者発表
理化学研究所
東京大学
京都大学
国立長寿医療研究センター
発表概要
理化学研究所(理研)生命医科学研究センター循環器ゲノミクス・インフォマティクス研究チームの伊藤薫チームリーダー、宮澤一雄訪問研究員、東京大学大学院医学系研究科の小室一成教授、野村征太郎特任助教、伊藤正道特任助教、東京大学大学院新領域創成科学研究科の鎌谷洋一郎教授、京都大学大学院医学研究科の沖真弥特定准教授、国立長寿医療研究センターの尾崎浩一メディカルゲノムセンター長(理研生命医科学研究センター循環器ゲノミクス・インフォマティクス研究チーム客員主管研究員)らの共同研究グループは、大規模なゲノムデータから心房細動[1]のゲノムワイド関連解析(GWAS)[2]を行い、疾患の遺伝的基盤に基づく新しい知見を明らかにしました。
本研究成果は、心房細動の病態解明から新しい治療ターゲットの同定に加え、個人のゲノム情報に基づく精密化医療[3]の実現に貢献すると期待できます。
今回、共同研究グループは、バイオバンク・ジャパン[4]のゲノムデータを用いた日本人のGWASとヨーロッパ人のGWASをメタ解析[5]した世界最大規模の民族横断的GWASを実施し、新しい疾患感受性座位[6]を同定しました。さらにChIP-seq[7]のデータを用いた解析では、転写因子[8]ERRgが心房細動の関連遺伝子の発現調整と関わることを明らかにしました。また、GWASの結果から構築した遺伝的リスクスコア(PRS)[9]が疾患の発症年齢や心原性脳梗塞[10]の予測、さらに脳梗塞死を含む心血管死の予後予測にも有用であることを示しました。
本研究は、科学雑誌『Nature Genetics』オンライン版(1月19日付:日本時間1月19日)に掲載されました。
民族横断的な大規模ゲノムデータを用いた心房細動のゲノム解析
発表内容
背景
心房細動は、心筋細胞の異常な電気的興奮による不規則で速い心臓の拍動から、動悸や息切れの症状を呈する不整脈です。高齢化社会に伴い有病率は増加しており、また心臓の機能低下や血栓形成による心不全や脳梗塞などを引き起こすことから、心房細動に対する診療の向上は医学的また医療経済的に重要な問題になっています。
心房細動は環境要因に遺伝要因も加わった多因子疾患であることが知られており、近年は大規模なコホートデータを用いたゲノムワイド関連解析(GWAS)により、多くの疾患感受性座位が同定されてきました。しかし、これら疾患感受性座位の多くがタンパク質をコードしないノンコーディング領域に存在するため、疾患発症につながる遺伝子やその転写制御に関するメカニズムは十分に解明されていません。さらに、GWASなどのゲノム解析の結果は実際の臨床診療に反映されていないのが現状です。
そこで本研究では、バイオバンク・ジャパンのデータを用いた心房細動GWASに加えて、2018年に報告されたヨーロッパ人の心房細動GWAS注1)とフィンランド人のFinnGen[11]コホートで報告されたGWAS注2)を組み合わせたメタ解析を行いました。そこにエピゲノム[12]やトランスクリプトーム[13]のデータを統合して、心房細動に関連する遺伝子やその転写制御の解明を試みました。さらに、メタ解析の結果から疾患予測に有用な遺伝的リスクスコア(PRS)を構築し、心房細動に関連するさまざまな病態との関連解析を行うことで、PRSが臨床実装に資する性能を持つか評価しました。
注1)Nielsen,J.B. et al, Biobak-driven genomic discovery yields new insight into atrial fibrillation biology. Nat Genet. 2018;50:1234-1239.
注2)FinnGen; https://www.finngen.fi/en
研究手法と成果
まず、共同研究グループはバイオバンク・ジャパンのデータから約15万人の臨床データとゲノムデータを用いて、日本人を対象とした心房細動のGWASを行い、以前のGWASで検出されなかった五つの疾患感受性座位を同定しました。この中には、ヨーロッパ人では報告されていない遺伝的多型(バリアント)[2]が含まれており、特にSYNE1遺伝子の近傍に位置するバリアントはSpliceAI[14]というアルゴリズムを用いた解析で、SYNE1遺伝子のRNAスプライシング[14]に関わることが予測されました。SYNE1遺伝子は核膜と細胞質の構造に重要な核膜タンパク質をコードしており、その遺伝子異常は拡張型心筋症[15]で報告されていることから、心房細動と拡張型心筋症に共通した疾患発症メカニズムが推測されました。そこでこの結果に、ヨーロッパ人で最大となるGWASとフィンランドの大規模ゲノムコホートであるFinnGenのデータを用いたGWASを組み合わせた民族横断的GWASのメタ解析を実施し、33の新しい座位を含む150の疾患感受性座位を同定しました。
続いて、これらの疾患感受性座位がどの遺伝子を介して心房細動の発症につながるかを調べるため、各組織での遺伝子発現量をまとめた国際プロジェクトGTEx[16]のデータベースを用いて、トランスクリプトームワイド関連解析[17]を実施しました。心臓の左心耳(左心房内にある袋状の構造をした心筋組織)と左心室における遺伝子発現量を用いた解析では、それぞれ132の遺伝子、127の遺伝子が心房細動と有意な関連を認めました。この中には、以前から関連遺伝子と報告されているイオンチャネル(細胞の生体膜にあるタンパク質で、イオンを透過させることで心筋細胞の電気的興奮が発生する)や転写因子の遺伝子に加えて、免疫反応に関わるIL6R遺伝子が含まれていました。この結果から、IL6R遺伝子を含む炎症反応のプロセスが疾患の病態に関わっていることが示唆されました。
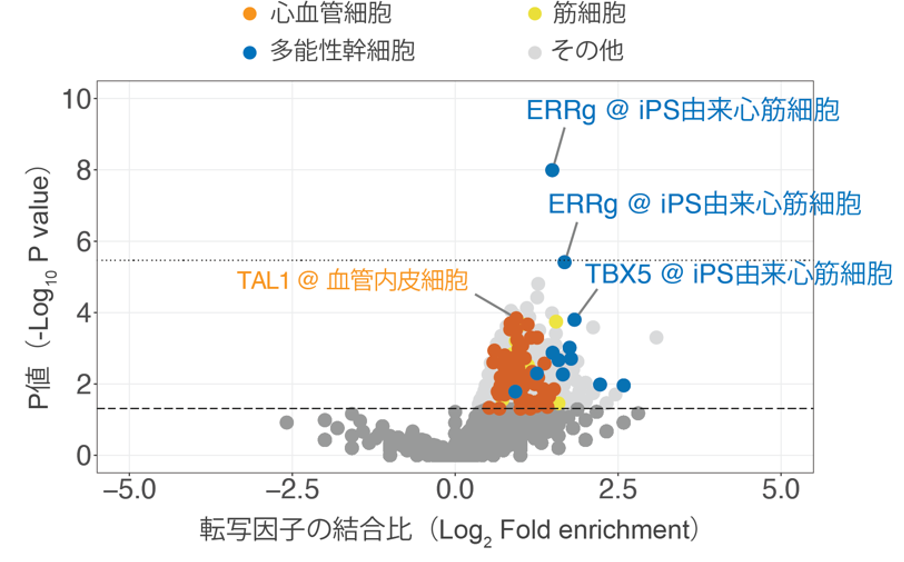
次に、心房細動の関連遺伝子の発現調整に関わる転写因子を同定するため、1,028の転写因子に対するChIP-seqの実験データを集積したChIP-Atlas注3)のデータベースを使用しました。各転写因子の結合部位を調べた15,109のChIP-seqデータとGWASの結果から得られた疾患感受性座位のデータからエンリッチメント解析[18]を行い、転写因子ERRgが心房細動の疾患感受性座位と有意な関連を認めました(図1)。ERRgが関連遺伝子の発現に関わっているかを調べるため、実際にiPS細胞[19]由来の心筋細胞を用いた機能解析も行いました。ERRgのインバースアゴニスト(逆作動剤)[20]を投与したiPS心筋細胞では、イオンチャネルをコードするCAML2遺伝子、HCN4遺伝子、KCND3遺伝子、KCNH2遺伝子、KCNJ5遺伝子、KCNN2遺伝子、KCNN3遺伝子、またサルコメア(筋肉が収縮する一つの単位)を構成するNEBL遺伝子とTTN遺伝子の発現量が有意に低下しました。
注3)ChIP-Atlas; https://chip-atlas.org/
図1 ChIP-Atlasを用いた心房細動ゲノムワイド関連解析(GWAS)と転写因子の関連
ChIP-Atlasに集積されているChIP-seqデータを用いて、心房細動のGWASで検出された疾患感受性座位とそれ以外の領域で結合する転写因子の比(エンリッチメント)とそのP値(統計学的に有意かどうか)を調べた。図の各ポイントは個々のChIP-seqの実験データを示している。エンリッチメント解析の結果、iPS細胞由来の心筋細胞における転写因子ERRgが有意に結合することが分かった。
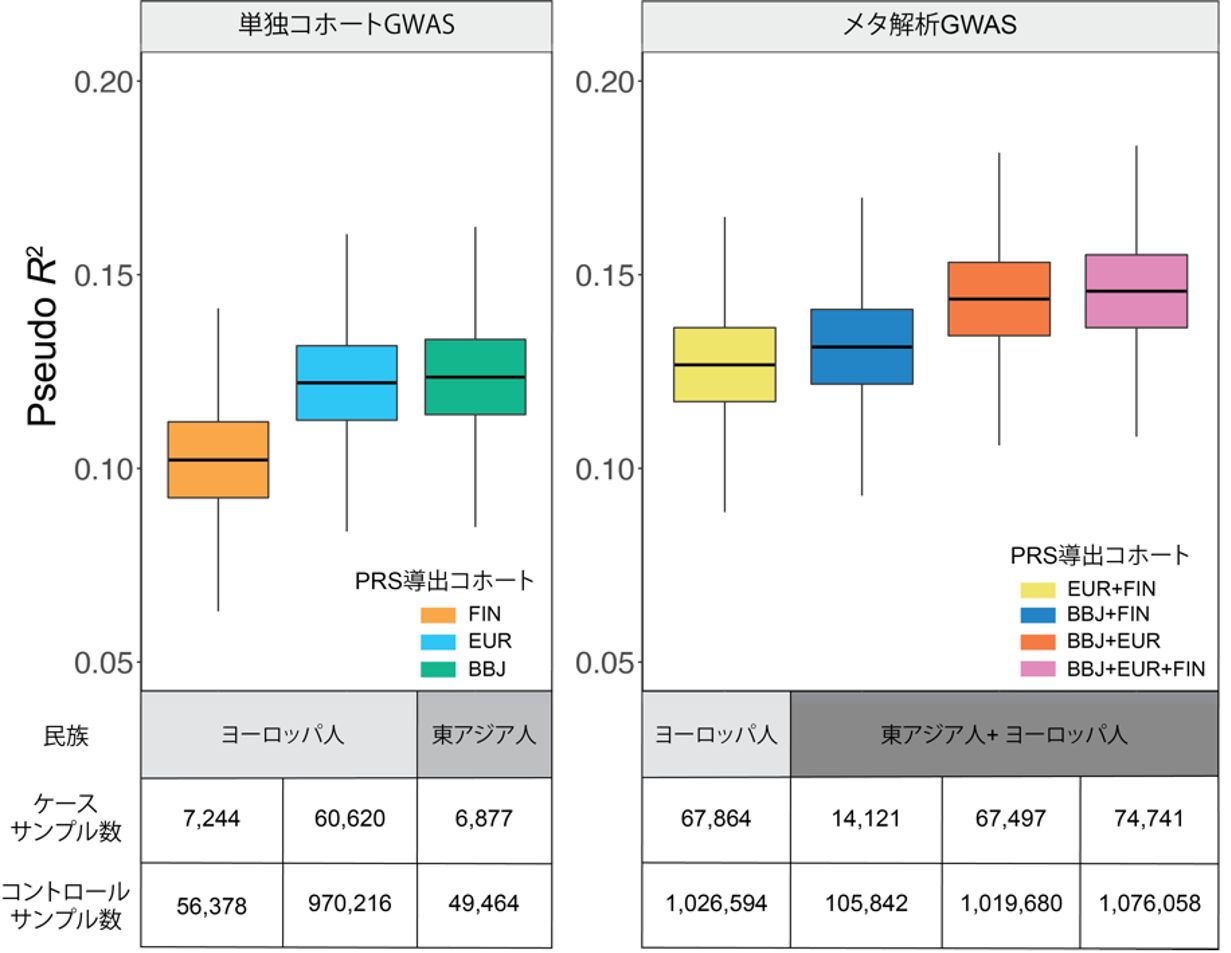
最後に、GWASの結果を用いて疾患の予測に有用なPRSの構築を行いました。PRSは導出元のGWASによってその性能が大きく異なるため、本研究で利用した三つのコホートに対して単独もしくは複数のメタ解析をした計7パターンのGWASからPRSを導出しました。その結果、単民族(単独コホート)のGWASから導出したPRSは性能評価を行う集団と一致していればサンプルサイズによらず性能が高いことが分かりました(図2左)。また、単民族のGWASから導出したPRSに比べて、多民族(メタ解析)のGWASから導出したPRSは予測性能が高く、さらにサンプルサイズが最も多くなる三つのコホートのメタ解析から導出したPRSが最も高い予測性能を示すことが分かりました(図2右)。
図2 各GWASから導出した心房細動の遺伝的リスクスコア(PRS)の性能評価
バイオバンク・ジャパンのサンプルを用いたGWAS(BBJ)とヨーロッパ人を対象とした心房細動GWASのメタ解析(EUR)、FinnGenコホートを用いた心房細動GWAS(FIN)、またそれぞれの組み合わせから導出したPRSの性能をバイオバンク・ジャパンのサンプルに当てはめて性能評価を行った。
(左)単独コホートのGWASから導出したPRSは、導出元の民族と当てはめる民族が一致していればサンプルサイズが少なくても性能が高いことが分かった。
(右)メタ解析のGWASから導出したPRSは、単独コホートGWASのPRSよりも性能は高く、さらに複数の民族を組み合わせてサンプルサイズが最も多くなるGWASのPRS(ピンク)は、全てのPRSの中で最も性能が優れていた。
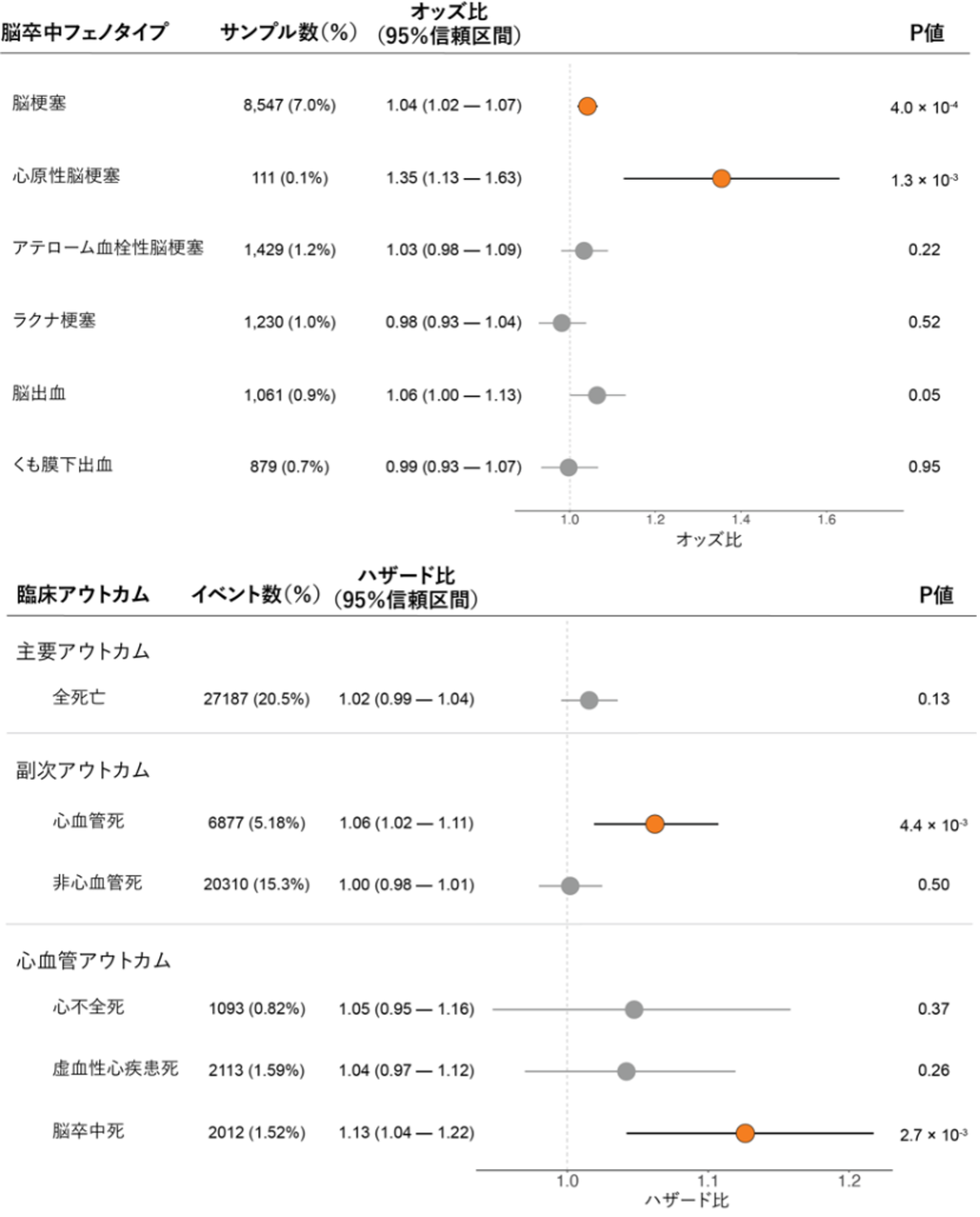
さらにPRSの特性を調べるため、心房細動と関連する病態とPRSの関連解析を行いました。最も性能の良かったPRSをバイオバンク・ジャパンの心房細動サンプルに適用したところ、PRSと心房細動の発症年齢で相関が認められ、PRSが高くなるほど心房細動の発症年齢が若くなることが分かりました。次に、心房細動と診断されていないコントロールサンプルにPRSを適用したところ、PRSが脳梗塞と有意な関連を示しました。特に、心原性脳梗塞とPRSの間で強い関連が認められました。これは、心房細動のPRSが臨床的に診断されていない潜在性の心房細動や血栓形成を引き起こすような病態を予測していると推測されました。そして、バイオバンク・ジャパンのサンプルの長期フォローアップデータを用いて心房細動のPRSと予後の関連解析を行いました。その結果、心房細動のPRSと心血管疾患による死亡に有意な関連が示され、特に脳梗塞による死亡と強い関連があることが分かりました(図3)。
図3 心房細動PRSと脳卒中フェノタイプ(上段)、臨床アウトカム(下段)の関連
(上段)心房細動PRSを心房細動と診断されていないコントロールサンプルに適用し、心房細動PRSと脳卒中の各フェノタイプ(表現型)との関連をオッズ比(心房細動PRSが上昇したときの各脳卒中フェノタイプを有するリスクの大きさ)とP値(統計学的に有意な結果かどうか)を用いて示した。その結果、心房細動PRSは脳梗塞との有意な関連があり、特に心原性脳梗塞とは強い関連があることが分かった。
(下段)長期フォローアップデータを用いて、心房細動PRSと臨床アウトカムの関連をハザード比(心房細動PRSが上昇したときの各臨床アウトカムを発症するリスクの大きさ)とP値(統計学的に有意な結果かどうか)を用いて示した。その結果、心房細動PRSは心血管死との有意な関連を示し、特に脳卒中による死亡との強い関連が認められた。
本研究は大規模なゲノムデータを用いた解析に加えて、遺伝子発現や転写因子のデータを組み合わせることで、心房細動の発症に関連する新しい遺伝的基盤を明らかにしました。これらの結果は、疾患の病態を示すバイオマーカーや新しい治療ターゲットの開発につながると期待できます。
さらに、ゲノムデータに基づいたPRSは疾患予測に限らず、さまざまな病態や予後の予測に有用であることが示されました。今後、ゲノム解析の結果を実際の診療に応用することで、個人の病態に応じた精密化医療の実現に貢献すると期待できます。
論文情報
<タイトル>
Cross-ancestry genome-wide analysis of atrial fibrillation unveils disease biology and enables cardioembolic risk prediction
<著者名>
Kazuo Miyazawa, Kaoru Ito, Masamichi Ito, Zhaonan Zou, Masayuki Kubota, Seitaro Nomura, Hiroshi Matsunaga, Satoshi Koyama, Hirotaka Ieki, Masato Akiyama, Ryo Kurosawa, Hiroki Yoshida, Kouichi Ozaki, Yoshihiro Onouchi, BioBank Japan Project, Atsushi Takahashi, Koichi Matsuda, Yoshinori Murakami, Hiroyuki Aburatani, Michiaki Kubo, Yukihide Momozawa, Chikashi Terao, Shinya Oki, Hiroshi Akazawa, Yoichiro Kamatani, and Issei Komuro
<雑誌>
Nature Genetics
<DOI>
10.1038/s41588-022-01284-9
用語解説
[1] 心房細動 戻る
心臓の一部である心房での異常な電気興奮により心房が小刻みに震えて起きる不整脈のこと。脈の乱れから動悸や息切れ、胸の不快感などを呈する。また心房の機能低下から、脳梗塞のリスクとなる血栓の形成を引き起こす。
[2] ゲノムワイド関連解析(GWAS)、遺伝的多型(バリアント) 戻る
ゲノムワイド関連解析(GWAS)は、ゲノムを構成するDNAの塩基配列のうち、個体間で異なるゲノム上の部位である遺伝的多型(バリアント)と疾患発症の関連を網羅的に検索する手法である。疾患の罹患状態とバリアントの有無について、年齢や性別などを考慮しながら統計学的に解析する。2002年に理化学研究所が世界に先駆けて報告した手法であり、疾患以外にも身長や体重などさまざまな形質で報告されている。GWASはGenome-Wide Association Studyの略。
[3] 精密化医療 戻る
ゲノム情報に基づいた遺伝的要因を考慮し、同一疾患でも個人の病態やリスクに応じた層別化を行うことで、それぞれの患者に最適化した医療の提供を目指すもの。
[4] バイオバンク・ジャパン 戻る
日本人集団27万人を対象とした、大規模な疾患バイオバンク。日本医療研究開発機構の「オーダーメイド医療の実現プログラム」を通じて実施され、ゲノムDNAや血清サンプルを臨床情報と共に収集し、研究者へ提供している。2003年から東京大学医科学研究所内に設置されている。
[5] メタ解析 戻る
複数の独立した研究から得られた解析結果を統合するための統計学的手法。
[6] 疾患感受性座位 戻る
ゲノム解析の結果から目的の疾患と有意な関連を示す複数のバリアントが位置するゲノム上の領域。
[7] ChIP-seq 戻る
メチル化などのヒストン修飾や転写因子のDNA結合部位をゲノム領域全体で網羅的に検出する技術。特異的抗体を用いた免疫沈降により目的のDNA断片を精製し、次世代シークエンサーで解析する。
[8] 転写因子 戻る
DNAに結合して目的の遺伝子の転写を促進または抑制するタンパク質。遺伝子の上流にあるプロモーター部位を認識してRNAポリメラーゼの足場となるタンパク質複合体を形成するほか、エンハンサー部位に結合して転写の効率の調節に関わる。
[9] 遺伝的リスクスコア(PRS) 戻る
GWASの結果に基づいて、ゲノム全体に分布する多数のバリアントの影響を足し合わせることで計算される。疾患の発症などを予測するスコアとして注目されている。PRSはPolygenic Risk Scoreの略。
[10] 心原性脳梗塞 戻る
心臓で形成された血栓が流れて、脳の血管を閉塞して起きる脳梗塞。脳梗塞全体の中で15~20%を占める。心原性脳梗塞の多くは心房細動による血栓形成が原因となる。
[11] FinnGen 戻る
フィンランドで実施されているバイオバンク機構。国家規模で行われているプロジェクトで、50万人を目標に臨床情報やゲノムデータを収集している。
[12] エピゲノム 戻る
DNAのメチル化や、ヒストンのメチル化・アセチル化といった化学修飾の総体。遺伝子発現の調節機構に関わる。
[13] トランスクリプトーム 戻る
一つのゲノム、または特定の細胞や組織、器官で生産される転写産物(転写によって合成されたRNA)の総体を指す。
[14] Splice AI、RNAスプライシング 戻る
DNAから転写されたRNAはエクソンとイントロンと呼ばれる2種類の領域を含んでいるが、このうちタンパク質への翻訳に不要なイントロンの領域は取り除かれ、成熟したRNAとなる。このイントロンが除去される過程をRNAスプライシングと呼ぶ。Splice AIは、異常なRNAスプライシングに関連するバリアントの予測に有用な深層学習のアルゴリズムである。各バリアントに対して異常なRNAスプライシングを引き起こす確率を0から1までのスコアで与える。
[15] 拡張型心筋症 戻る
心臓の筋肉の収縮能力が低下し、特に全身に血液を送り出す左心室が拡張する心臓疾患。適切な治療を行っても慢性的に心不全の状態が持続し、さらに心臓の拡大が徐々に進行し、最終的には心臓移植が必要となる難治性疾患である。
[16] GTEx 戻る
ヒトの組織特異的な遺伝子発現量とバリアントに関する大規模なデータ構築を目指している国際プロジェクト。死後のドナーから臓器や組織の提供を受けて、ヒトの体組織ごとに遺伝子発現量に影響するバリアントを網羅的に解析しデータを集積している。GTExはGenotype-Tissue Expressionの略。
[17] トランスクリプトームワイド関連解析 戻る
遺伝子発現量とバリアントのデータに基づいて、ゲノム情報から遺伝子発現量を予測し、その予測値と目的の形質との関連を網羅的に探索する解析手法。
[18] エンリッチメント解析 戻る
ChIP-Atlasのデータを用いたエンリッチメント解析は、疾患感受性座位など目的のゲノム領域またはモチーフ配列に結合する転写因子などを調べる解析手法。
[19] iPS細胞 戻る
ヒトを含む哺乳類の体細胞にOct3、Sox2、Klf4遺伝子などを導入し培養することで、全ての種類の組織や臓器の細胞に分化する能力を持つ人工多能性幹細胞のこと。iPSはinduced Pluripotent Stemの略。
[20] インバースアゴニスト(逆作動剤) 戻る
目的の物質や受容体に結合して、その活性を減弱させることで、細胞内シグナルの発生を抑制する物質。