多遺伝子リスクスコア構築により日本人アルツハイマー病の遺伝的リスクを解明―アルツハイマー病のリスク層別化と個別化医療への応用に期待―
- ヘッドライン
- 記者発表
東京大学大学院新領域創成科学研究科
新潟大学
発表のポイント
◆多遺伝子(ポリジェニック)リスクスコアモデルを開発し、日本人アルツハイマー病の遺伝的リスクを明らかにしました。
◆ポリジェニックリスクスコアは、アルツハイマー病を発症するリスクと相関し、認知機能やバイオマーカーと関連することが明らかになりました。
◆アルツハイマー病の遺伝的リスクによる層別化に基づいた個別化医療に向けた応用が期待されます。
日本人アルツハイマー病のポリジェニックリスク解析
概要
東京大学大学院新領域創成科学研究科の菊地正隆特任准教授と新潟大学脳研究所の池内健教授らの研究グループは、ポリジェニック効果(注1)を定量化する数理モデルを日本人アルツハイマー病に対して初めて開発しました。この数理モデルを用いて計算されたポリジェニックリスクスコア(PRS、注2)はアルツハイマー病の発症リスクや認知機能、バイオマーカー等と関連することを明らかにしました。
近年、個々人レベルで遺伝的リスクが定量可能なスコアであるPRSが注目されています。多くの研究は欧米人を対象にPRSが検討されてきましたが、日本人アルツハイマー病に対するPRSの有効性は不明でした。本研究では、日本人アルツハイマー患者のゲノムデータを用いたPRSモデルを開発し、その有用性を明らかにしました。
今回開発したモデルによって算出されたPRSは、健常者と比べてアルツハイマー病患者で有意に高いことが示されました。さらに、独立した異なる日本人コホート(注3)においても、同様の傾向が再現されました。またアルツハイマー病の前駆段階である軽度認知障害(MCI)において、高PRSグループは低グループと比べアルツハイマー病を発症するリスクが高いことが示されました。アルツハイマー病のリスクを示すPRSを用いて個々人を層別化することにより、リスクに応じた個別化医療が推進されると期待されます。
本研究は、科学雑誌『Alzheimer's Research & Therapy』オンライン版(2月27日付:日本時間2月28日)に掲載されました。
発表内容
アルツハイマー病は認知症の中で最も頻度が高い疾患です。アルツハイマー病の最大の危険因子は老化ですが、それに加えて特定の遺伝的バリアントを生まれつき多くもっている方は発症リスクが高いことが知られています。この遺伝的リスクの強さを個人ごとに算出する方法として近年PRSが注目されています。PRSは個人がもつ複数の遺伝的リスクを一つの値に集約したスコアで、主に欧米人を対象に研究が行われてきました。しかしゲノム情報は国や地域によって多様性があるため、アルツハイマー病のPRSを評価するためには、異なるコホートのゲノムデータを用いた検証が必要です。
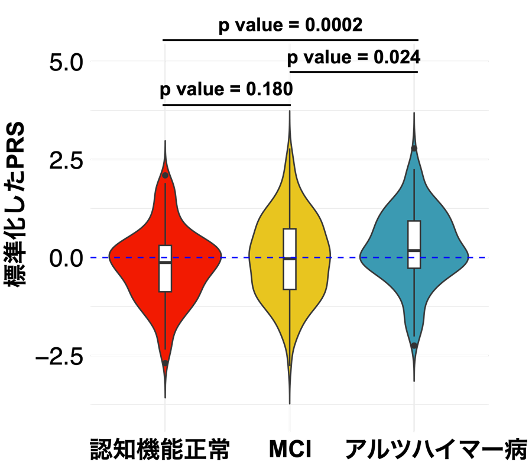
本研究ではJ-ADNI研究(注4)により集積された日本人アルツハイマー病患者139人と健常高齢者145人(計284人)のゲノムデータを用いてアルツハイマー病のPRSモデルを構築しました。このモデルにより算出したPRSは健常者と比べてアルツハイマー病患者で有意に高いことが示されました(図1)。
図1:グループ別のPRS
アルツハイマー病患者では認知機能正常やMCIと比べてPRSが高いことが分かりました。
さらに神経病理学コホート由来のアルツハイマー病212人と対照群365人(計565人)で構成される独立した日本人コホートに適用した場合でも、同様の結果が再現されました。さらにPRSは認知機能や、アルツハイマー病の原因タンパクの一つであるタウタンパク(注5)の髄液中濃度とも関連することが分かりました。
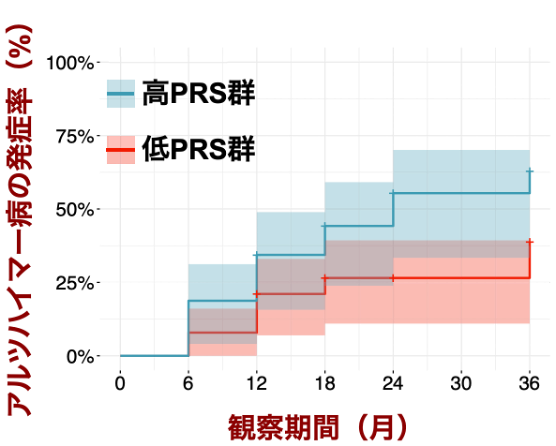
またアルツハイマー病の前駆段階であるMCI 220人についてPRSを計算し、そのうち単一の対立遺伝子であるAPOEε4(注6)を持たない患者群を高PRS群と低PRS群に分けてアルツハイマー病発症について縦断的に比較しました。その結果、高PRS群は低PRS群と比べてアルツハイマーを発症するリスクが高いことが分かりました(図2)。
図2:PRSで層別化したMCI患者のアルツハイマー病発症リスク
APOEε4を持たないMCI患者をPRSに基づき低PRS群と高PRS群に層別化し、観察経過に伴うアルツハイマー病の発症率を比較しました。高PRS群は低PRS群よりもより早期に発症率が増加することが分かりました。
今回開発した日本人のアルツハイマーPRSモデルはアルツハイマー病の発症リスクの推定や、アルツハイマー病治療薬が奏功するグループを見極める層別化に向けた応用が期待されます。今後は脳画像や血液バイオマーカー等の情報をPRSに統合するなど工夫することで、精度の高い個別化医療が提供できるようになることが期待されます。
発表者・研究者等情報
東京大学
大学院新領域創成科学研究科
菊地 正隆 特任准教授
中谷 明弘 特任教授
大学院医学系研究科
岩坪 威 教授
新潟大学
脳研究所・生命科学リソース研究センター
池内 健 教授
宮下 哲典 准教授
春日 健作 助教
原 範和 特任助教
脳研究所・病理学分野
柿田 明美 教授
東京都健康長寿医療センター高齢者ブレインバンク
齊藤 祐子 部長
大阪大学大学院連合小児発達学研究科附属子どものこころの分子統御機構研究センター
村山 繁雄 特任教授(常勤)
兼:東京都健康長寿医療センター高齢者ブレインバンク 研究員
名古屋市立大学大学院医学研究科
赤津 裕康 教授
国立長寿医療研究センター研究所
メディカルゲノムセンター
尾崎 浩一 センター長
研究推進基盤センター
新飯田 俊平 センター長
旭川荘総合研究所特別研究部門
桑野 良三 研究員
論文情報
雑誌名:Alzheimer's Research & Therapy
題 名:Polygenic effects on the risk of Alzheimer's disease in the Japanese population
著者名:Masataka Kikuchi*, Akinori Miyashita, Norikazu Hara, Kensaku Kasuga, Yuko Saito, Shigeo Murayama, Akiyoshi Kakita, Hiroyasu Akatsu, Kouichi Ozaki, Shumpei Niida, Ryozo Kuwano, Takeshi Iwatsubo, Akihiro Nakaya, Takeshi Ikeuchi*, the Alzheimer's Disease Neuroimaging Initiative & the Japanese Alzheimer's Disease Neuroimaging Initiative(*責任著者)
DOI: 10.1186/s13195-024-01414-x
URL: https://doi.org/10.1186/s13195-024-01414-x
研究助成
本研究は、日本医療研究開発機構(AMED)領域横断的かつ萌芽的脳研究プロジェクト(課題番号:JP23wm0525019)、認知症研究開発事業(課題番号:JP23dk0207060)、認知症研究開発事業(課題番号:JP21dk0207045)、精神・神経疾患メカニズム解明プロジェクト(課題番号:JP21wm0425019)、科研費 若手研究(課題番号:20K15778)、基盤研究(C)(課題番号:21K07271)、基盤研究(B)(課題番号:21H03537)、学術変革領域研究(学術研究支援基盤形成)(課題番号:22H04923)、厚生労働科学研究費補助金(課題番号:202111056A)の支援により実施されました。
用語解説
(注1)ポリジェニック効果
多くの疾患や形質(身長や体重など)は単一の遺伝的バリアントでは説明できず複数の遺伝的バリアントによって説明されます。このような性質をポリジェニック効果や多遺伝子形質と呼びます。
(注2)ポリジェニックリスクスコア(PRS)
PRSは多数の遺伝的バリアントからなるリスク効果を足し合わせたスコアとして計算され、個人の遺伝的リスクを表現するために用いられます。
(注3)コホート
観察研究の対象となる集団。コホート研究では特定の基準を満たした集団を対象に、疾患の発症やリスク要因を追跡調査します。
(注4)J-ADNI研究
健常高齢者、MCI、軽度アルツハイマー病患者の精密評価を目的として日本全国38の医療機関が参加し、2008年より開始したコホート研究。2003年に米国で開始したAlzheimer's Disease Neuroimaging Initiative(ADNI)研究のプロトコルに準じて実施されました。J-ADNI研究では脳画像診断やバイオマーカー測定を縦断的に行い参加者の自然経過が評価されました。
(注5)タウタンパク
アルツハイマー病患者死後脳では神経細胞表面に蓄積した老人斑と、神経原線維変化の細胞内蓄積という二つの神経病理学的特徴があり、これらの蓄積が神経細胞死を誘導すると言われています。神経原線維変化は異常にリン酸化したタウタンパクの凝集体で、神経細胞死が進むと細胞内に溜まったタウタンパクが露出し髄液に流れ出ると考えられています。その結果、アルツハイマー病患者の髄液中では健常者と比べ高濃度のタウタンパクが検出されます。
(注6)APOEε4
アルツハイマー病の最大の遺伝的リスク因子。APOE遺伝子は二つの遺伝的バリアント(rs429358とrs7412)によって主に三つの対立遺伝子(ε2、ε3、ε4)が存在します。この中でε4はアルツハイマー病の発症リスクを増加させることが知られています。これまでアルツハイマー病を対象に行われたゲノムワイド関連解析では人種に関係なく最も高いリスクを示すことが報告されています。
関連研究室