アトピー性皮膚炎の発症年齢の遺伝基盤-発症年齢の多遺伝子構造も考慮した世界初の研究-
- ヘッドライン
- 記者発表
理化学研究所
東京大学
静岡県立総合病院
静岡県立大学
発表概要
理化学研究所(理研)生命医科学研究センターゲノム解析応用研究チームの寺尾知可史チームリーダー(静岡県立総合病院臨床研究部免疫研究部長、静岡県立大学薬学部ゲノム病態解析講座特任教授)、ファーマコゲノミクス研究チームの曳野圭子特別研究員、莚田泰誠チームリーダー、東京大学大学院新領域創成科学研究科メディカル情報生命専攻複雑形質ゲノム解析分野の小井土大助教(理研生命医科学研究センターゲノム解析応用研究チーム客員研究員)らの共同研究グループは、2021年に発表したアトピー性皮膚炎を対象にした最大規模のゲノムワイド関連解析(GWAS)[1]の結果を用いて、日本人のアトピー性皮膚炎の発症年齢の遺伝基盤を解明しました。
本研究成果は、発症年齢によるアトピー性皮膚炎の病態の違いのさらなる解明とそれらを考慮した治療選択、高リスク患者に対する遺伝的に発症するリスクの高さによって層別化された早期介入に貢献するものと期待できます。
これまでに、アトピー性皮膚炎の遺伝的リスクは報告されていますが、発症年齢に対する遺伝的関与はほとんど研究されていませんでした。
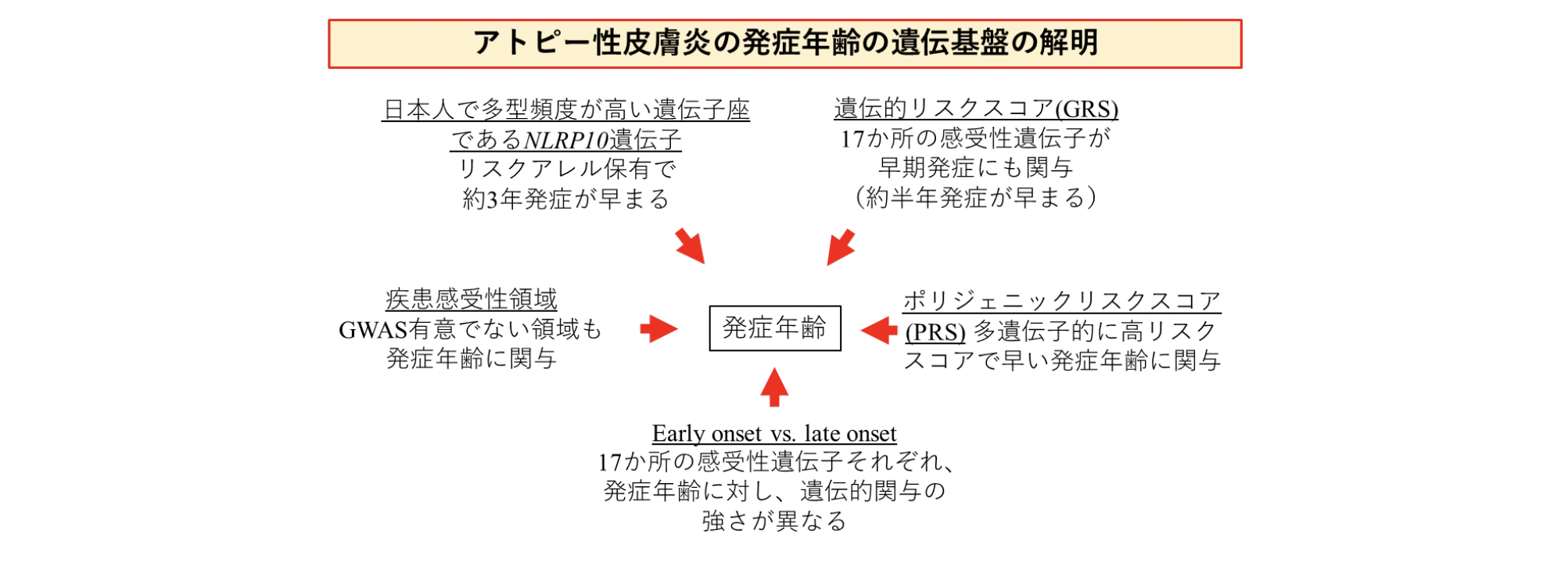
今回、共同研究グループは、バイオバンク・ジャパン(BBJ)[2]に登録された約2,600人のアトピー性皮膚炎患者のデータを対象に、発症年齢に対する遺伝的影響を調べました。その結果、(1)特に日本人で遺伝的多型[1]の頻度が高い遺伝子座であるNLRP10遺伝子[3]のリスクアレル[4]を持つと発症年齢が約3年早まること、(2)アトピー性皮膚炎は年齢依存的な多遺伝子構造を示し、遺伝的リスクが高いほど発症が早まること、(3)17カ所の疾患感受性領域[5]それぞれにおいて、発症年齢に及ぼす遺伝的影響の強さが異なることを解明しました。
本研究は、科学雑誌『Journal of Investigative Dermatology』(2022年12月号)に掲載されました。
本研究の概要
発表内容
背景
発症年齢によるアトピー性皮膚炎の症状の違いは報告されていますが、その原因は分かっていません。また、発症年齢に対する遺伝的関与はさまざまな疾患で研究されていますが、アレルギー疾患ではほとんど例がなく、とりわけアトピー性皮膚炎においては、主にヨーロッパの集団を対象とした限られた既報があるのみでした注1、2)。よって、アジア人集団において、全ゲノムレベルで発症年齢の遺伝基盤を解明することが求められていました。
そこで共同研究グループは、2021年に報告した、バイオバンク・ジャパン(BBJ)に登録されている約2,600人のアトピー性皮膚炎患者のデータを用いて行った大規模なゲノムワイド関連解析(GWAS)の結果を活用し注3)、発症年齢の基盤となる遺伝子構造を調べました。
(注1)Wan J. et al. Influence of FLG mutations and TSLP polymorphisms on atopic dermatitis onset age. Ann Allergy Asthma Immunol. 2017;118(6):737-738
(注2)Ferreira M. et al. Age-of-onset information helps identify 76 genetic variants associated with allergic disease. PLoS Genet. 2020;16(6):e1008725
(注3)Tanaka N, et al. Eight novel susceptibility loci and putative causal variants in atopic dermatitis. J Allergy Clin Immunol. 2021;148(5):1293-1306.
研究手法と成果
共同研究グループは2021年、アトピー性皮膚炎患者に特徴的な遺伝的変異を網羅的に検出するために、BBJの登録者の中のアトピー性皮膚炎患者群2,597人と対照群11万504人(合計11万3101人)を対象に、非ヨーロッパ人集団としては最大規模となるGWASを行い、17の疾患感受性領域を報告しました。本研究ではさらに、発症年齢情報を持つアトピー性皮膚炎患者1,344人を対象に、発症年齢との遺伝的関連を調べました。
最初に、GWASでゲノムワイド有意水準[6](p<5.0×10-8)を満たす、17のアトピー性皮膚炎感受性領域と発症年齢の関連を調べたところ、特に日本人で多型頻度が高い遺伝子座であるNLRP10遺伝子が有意に関連することが分かりました(p<5.8×10-4)。そして、この遺伝子のリスクアレルを持つと、発症年齢が約3年早まることが示されました。
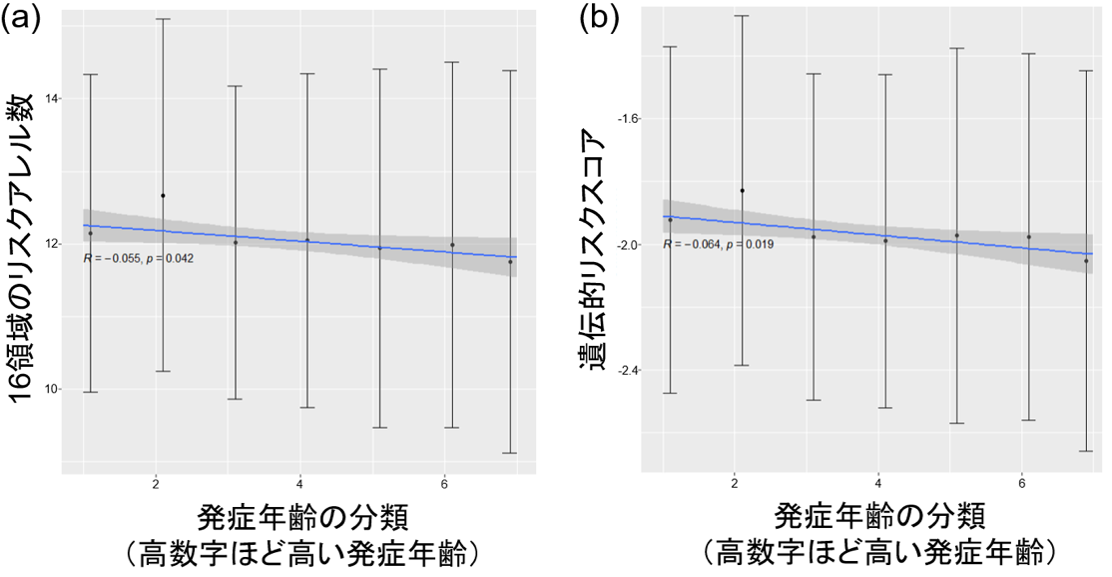
次に、NLRP10遺伝子以外の16の疾患感受性領域でのリスクアレル数、あるいは遺伝的リスクスコア(GRS)[7]と発症年齢との相関を調べたところ、リスクアレル数、GRSともに、発症年齢と有意に逆相関(負の相関)していました(図1)。また、17の疾患感受性領域のリスクアレルをそれぞれ持つと、平均して約半年発症が早いことが分かりました。これらの結果から、疾患感受性遺伝子は年齢特異性を考慮して解釈すべきこと、そして遺伝的影響が強ければ早い発症につながることが示されました。
図1 日本人のアトピー性皮膚炎の遺伝的リスクと発症年齢との関係
横軸が発症年齢の分類、縦軸がリスクアレル数(a)と遺伝的リスクスコア(b)を示す。黒点を含む縦線が標準偏差、青線が線形回帰曲線(リスクアレル数や遺伝的リスクスコアに対する発症年齢の傾向を統計的に示したもの)、灰色の帯が信頼帯(真の値を含む可能性の高い推定値の範囲)を示す。遺伝的因子が強ければ、早い発症につながることが分かった。
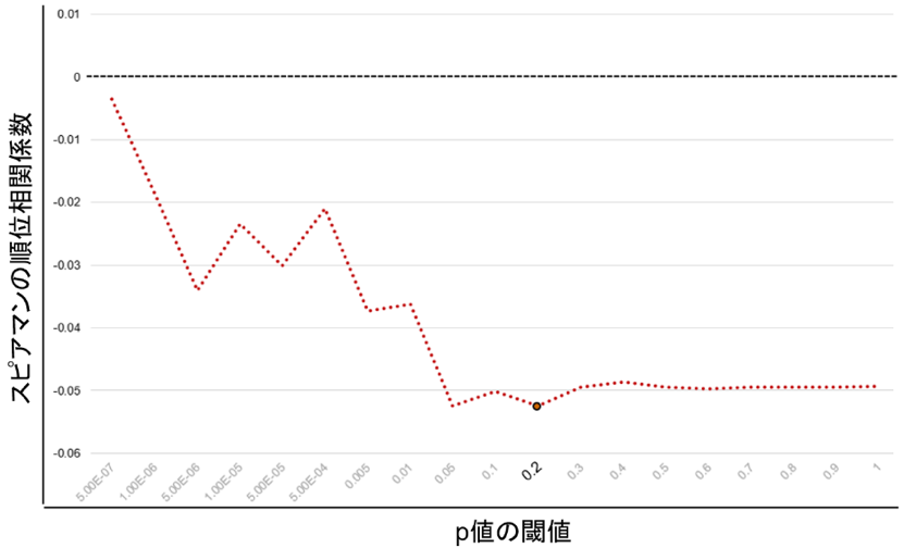
さらに、疾患感受性と発症年齢の遺伝子構造を多遺伝子レベルで解析しました。アトピー性皮膚炎のリスクと発症年齢に対し、一塩基多型(SNP)[1]の効果量の相関解析を行ったところ、アトピー性皮膚炎の疾患感受性GWASの有意領域以外のSNPにおいても有意に逆相関を示し、アトピー性皮膚炎のリスクと発症年齢両方においてGWAS有意領域以外でも遺伝的に関連があることが示されました。続いて、GWAS有意領域の影響を排除したポリジェニックリスクスコア(PRS)[8]を計算したところ、アトピー性皮膚炎の感受性と発症年齢には有意に逆相関が得られ(図2)、多遺伝子レベルにおいても、発症の遺伝的リスクが高ければ早い発症年齢につながることが分かりました。
図2 ポリジェニックリスクスコア(PRS)における相関係数
横軸がp値の閾値、縦軸がPRSのスピアマンの順位相関係数。スピアマンの順位相関係数は、二つの変数間の相関の強さと方向を測る指数である。閾値がp=0.2において有意に逆相関を示し、発症の遺伝的リスクが高ければ発症年齢が早まることが多遺伝子レベルでも示された。
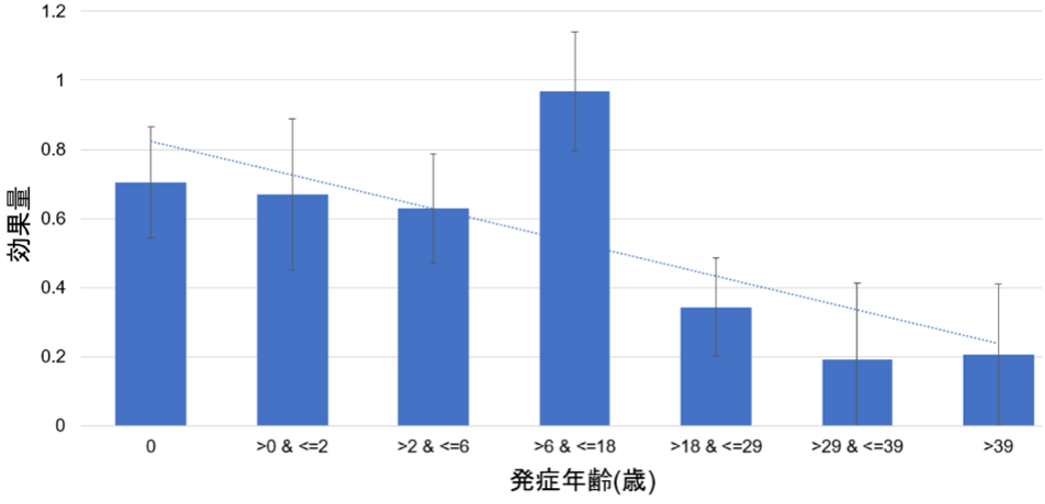
最後に、17カ所の疾患感受性領域の遺伝的リスクの効果量は、発症年齢の違い(early onsetあるいはlate onset)により異なっており(図3)、発症年齢によるアトピー性皮膚炎の異なる遺伝的構造が示されました。これは、17カ所の疾患感受性領域それぞれにおいて発症年齢に及ぼす遺伝的影響の強さが異なること、つまり発症年齢によるアトピー性皮膚炎の症状の違いが遺伝的要因による可能性を意味しています。
図3 日本人特有の遺伝子座であるNLRP10遺伝子の発症年齢ごとの効果量の比較
横軸が発症年齢、縦軸が効果量を示す。若年発症ほどNLRP10遺伝子の遺伝的リスクの効果量が大きい。
今後の期待
今回の研究では、日本人特有の特定の遺伝子座のリスクアレルを持つと発症年齢が約3年早まることを解明しました。また、アトピー性皮膚炎は年齢依存的な多遺伝子構造を示し、遺伝的リスクが高いほど発症が早まることが分かりました。さらに、アトピー性皮膚炎の疾患感受性領域それぞれの、発症年齢に及ぼす遺伝的影響の強さは異なることが解明されました。 これらの結果は、発症年齢によるアトピー性皮膚炎の病態のさらなる解明につながり、それぞれの病態に応じた新しい治療法や予防法の開発、高リスクの患者に対する遺伝的に発症するリスクの大きさによって層別化された早期介入に貢献できるものと期待できます。
論文情報
<タイトル>
Genetic architectures underlie onset age of atopic dermatitis
<著者名>
Keiko Hikino, Nao Tanaka, Masaru Koido, Kohei Tomizuka, Yoshinao Koike, Shuji Ito, Akari Suzuki, Yukihide Momozawa, Yoichiro Kamatani, The Biobank Japan Project, Taisei Mushiroda, Chikashi Terao
<雑誌>
Journal of Investigative Dermatology
<DOI>
10.1016/j.jid.2022.06.010
補足説明
[1] ゲノムワイド関連解析(GWAS)、遺伝的多型、一塩基多型(SNP)
一つの遺伝子座に、二つかそれ以上の頻度の高い異なるアレルが存在する状態のことを遺伝的多型という。一つの塩基が他の塩基に変わる多型を、一塩基多型(SNP)と呼ぶ。SNPはSingle Nucleotide Polymorphismの略。ゲノムワイド関連解析(GWAS)は形質に対する遺伝的関連を知るための手法であり、SNPを用いて解析するものが一般的である。形質(疾患の有無や量的形質)を目的変数、SNPの量的情報や各種共変量を説明変数にしてモデル化し、SNPの関連を評価する。GWASはGenome-Wide Association Studyの略。
[2] バイオバンク・ジャパン(BBJ)
日本人集団27万人を対象とした生体試料のバイオバンクで、東京大学医科学研究所内に設置されている。理化学研究所が取得した約20万人のゲノムデータを保有する。オーダーメイド医療の実現プログラムを通じて実施され、ゲノムDNAや血清サンプルを臨床情報とともに収集し、研究者へのデータ提供や分譲を行っている。詳細はバイオバンク・ジャパンのウェブサイト(https://biobankjp.org/index.html)を参照。
[3] NLRP10遺伝子
自然免疫に関連する遺伝子。炎症抑制・獲得免疫にも重要な役割を果たす。日本人に特異的なアトピー性皮膚炎関連領域であることが示されている。
[4] アレル
哺乳類は両親から染色体を1組ずつ受け継ぐ。この1対の遺伝子セットを対立遺伝子座またはアレルと呼ぶ。
[5] 疾患感受性領域
疾患の発症に関連している染色体上の領域、遺伝子座、SNPのこと。本研究で対象とした17領域には、自然免疫に関連するNLRP10遺伝子や、CCDC80領域のエンハンサー(遺伝子の発現を制御する機能を持つ)に重なる位置にあり、アレルギー反応の発生に関わる遺伝子、慢性炎症期や自然免疫において重要な役割を担うIL18RAP遺伝子などが含まれる。
[6] ゲノムワイド有意水準
通常の有意水準である0.05を100万で割り、5.0×10-8未満という厳しい判定基準を採用し、間違って有意であるという判定をしないように設定したGWAS独自の水準。
[7] 遺伝的リスクスコア(GRS)
ゲノム上の遺伝的変異の影響を足し合わせたスコアのこと。形質へのなりやすさの推定値。GRSはgenetic risk scoreの略。
[8] ポリジェニックリスクスコア(PRS)
GRSより多くの遺伝因子を考慮したGWAS研究により、形質との関連が示された遺伝的変異の重み付きの和を計算したスコアのこと。形質に対するリスクと相関するため、高リスクの人を特定できる。PRSはpolygenic risk scoreの略。
研究支援
本研究は、日本医療研究開発機構(AMED)オーダーメイド医療の実現プログラム「疾患関連遺伝子等の探索を効率化するための遺伝子多型情報の高度化(研究開発代表者:久保充明)」の助成を受けて行われました。