ポリジェニックリスクスコアで前立腺がんの死亡リスクを予測-アンドロゲン受容体の結合領域に着目した解析が有効-
- ヘッドライン
- 記者発表
理化学研究所
島根大学
静岡県立総合病院
静岡県立大学
東京大学
発表概要
理化学研究所(理研)生命医科学研究センターゲノム解析応用研究チームの伊藤修司客員研究員(島根大学医学部附属病院整形外科医科医員)、寺尾知可史チームリーダー(静岡県立総合病院免疫研究部長、静岡県立大学特任教授)、東京大学大学院新領域創成科学研究科の鎌谷洋一郎教授らの国際共同研究グループは、前立腺がんのゲノムワイド関連解析(GWAS)[1]ならびにポリジェニックリスクスコア(PRS)[2]を用いて、前立腺がん発症前でも、将来的な前立腺がんによる死亡リスクを予測できることを明らかにしました。
本研究成果は、前立腺がんの早期発見・早期治療の実現につながるものと期待できます。
前立腺がんは全がん種の中で最も高い遺伝率[3]を持つことから、予測モデルの構築には遺伝的要因を解明することが重要です。
今回、国際共同研究グループは、GWASおよびPRSを用いた、バイオバンク・ジャパン[4]のデータ解析により、前立腺がんと診断されていない男性が、将来的に前立腺がんを発症し死亡するリスクを予測できることを明らかにしました。この予測能は、前立腺細胞のゲノム上のアンドロゲン受容体結合領域[5]に着目して解析すると、さらに改善しました。
本研究は、オンライン科学雑誌『Nature Communications』(8月23日付:日本時間8月23日)に掲載されました。
発表内容
<研究の背景>
前立腺がんは男性において世界で2番目に多いがんであり、男性のがん死亡原因の6.7%を占めるとされています(注1)。その高い発症頻度と死亡数の多さ故に、前立腺がんの発症と死亡のリスクを予測することが予防医学の観点から重要です。前立腺がんは全てのがん種の中で最も高い遺伝率を持つことが分かっており(注2)、予測モデルの構築には遺伝的要因を解明する必要があります。
(注1)Bray, F. et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA. Cancer J. Clin. 68, 394-424 (2018)
(注2)Mucci, L. A. et al. Familial Risk and Heritability of Cancer Among Twins in Nordic Countries. JAMA 315, 68-76 (2016)
<研究手法と成果>
国際共同研究グループはまず、バイオバンク・ジャパンによって収集された日本人の前立腺がん患者8,645人と対照群89,536人(計98,181人)を対象に、ゲノムワイド関連解析(GWAS)を実施し、前立腺がんの発症に関わる32の領域を同定しました。そのうちの一つは新規領域で、最も関連の強い一塩基多型(SNP)[6]はがん抑制遺伝子ZFHX3のイントロン(遺伝情報がコードされていないゲノム領域)上にありました。この前立腺がんGWASの結果を用いて、LDスコア回帰法[7]により他の疾患との遺伝的相関を解析したところ、乳がんと正の相関が、慢性心不全や末梢血管疾患と負の相関が認められました。
さらに、既報のヨーロッパ人・アフリカ人・東アジア人・ヒスパニック系集団の国際メタ解析[8]のGWAS結果(注3)と今回の日本人のGWAS結果を統合し、前立腺がん患者107,218人と対照群197,733人(計304,951人)を対象にGWASを実施し、前立腺がんに関わる171領域を同定しました。また、統計的な原因多型(SNP)を探すために、国際メタ解析GWAS結果とヨーロッパ人のみのGWAS結果を基に、関連解析の一つであるファインマッピング[9]を実施しました。すると、ヨーロッパ人GWAS結果よりも国際メタ解析GWAS結果を用いた方が原因SNPを同定しやすくなることが分かりました。
アンドロゲン受容体は男性ホルモンの一種であるアンドロゲンと結合し、細胞核内で特定のDNA領域(アンドロゲン受容体結合領域)に結合し、転写因子[10]として働きます。国際共同研究グループはこのアンドロゲン受容体結合領域に着目し、形質間の遺伝的背景の共有を定量化するために、層別化LDスコア回帰法[7]を用いて解析しました。その結果、一般的なデータベース(ChIP-Atlas)から取得した、正常な前立腺細胞におけるアンドロゲン受容体結合領域に、前立腺がんの遺伝的リスクが強く集積していることが分かりました。
また、GREGOR[11]という手法を用いて解析したところ、国際メタ解析で検出された有意なSNPがアンドロゲン受容体結合領域に集積していることが分かりました。このアンドロゲン受容体結合領域に集積する傾向は、前立腺がん細胞よりも正常な前立腺細胞の方が強く、統計学的に原因多型である事後確率[12]の高いSNPほど強いことも分かりました(図1)。
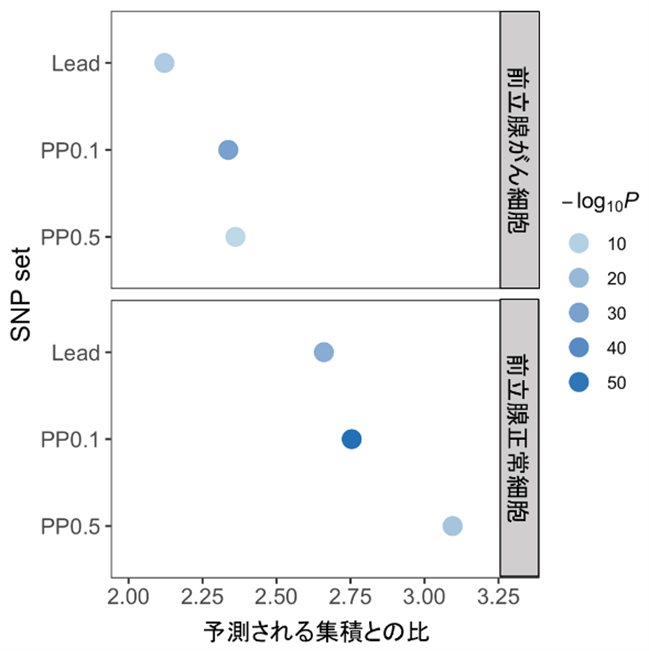
図1 アンドロゲン受容体結合領域におけるSNPの集積をGREGORで解析した結果
国際メタ解析で検出された有意なSNPのアンドロゲン受容体結合領域における集積について、GREGORで解析した。LeadはGWASの有意なSNPのうち領域で最もP値(統計学的有意差を示す指標であり、P値が低いほど偶然そのようなことは起こり得ないことを示す)が低いSNPを、PP0.1は統計学的に原因多型である事後確率が0.1以上のSNPを、PP0.5は統計学的に原因多型である事後確率が0.5以上のSNPを指す。有意なSNPのうち、統計学的に原因多型である事後確率が高いSNP(PP0.5)ほどアンドロゲン受容体結合領域に集積する傾向が強く、前立腺がん細胞よりも正常な前立腺細胞で集積する傾向が強い。
また、統計学的に原因多型である事後確率が高いSNPの中で、アンドロゲン受容体結合領域のモチーフ配列(転写因子が結合する塩基配列パターン)を変えて遺伝子発現を変化させることで、発症に影響を与えるSNPがあることも分かりました(図2)。以上のことは、前立腺がんの発症に、前立腺細胞のゲノム上のアンドロゲン受容体結合領域が重要であることを示しています。アンドロゲンは前立腺がんの治療標的であり、今回の解析結果は実際の臨床現場における知見とよく合致するものでした。
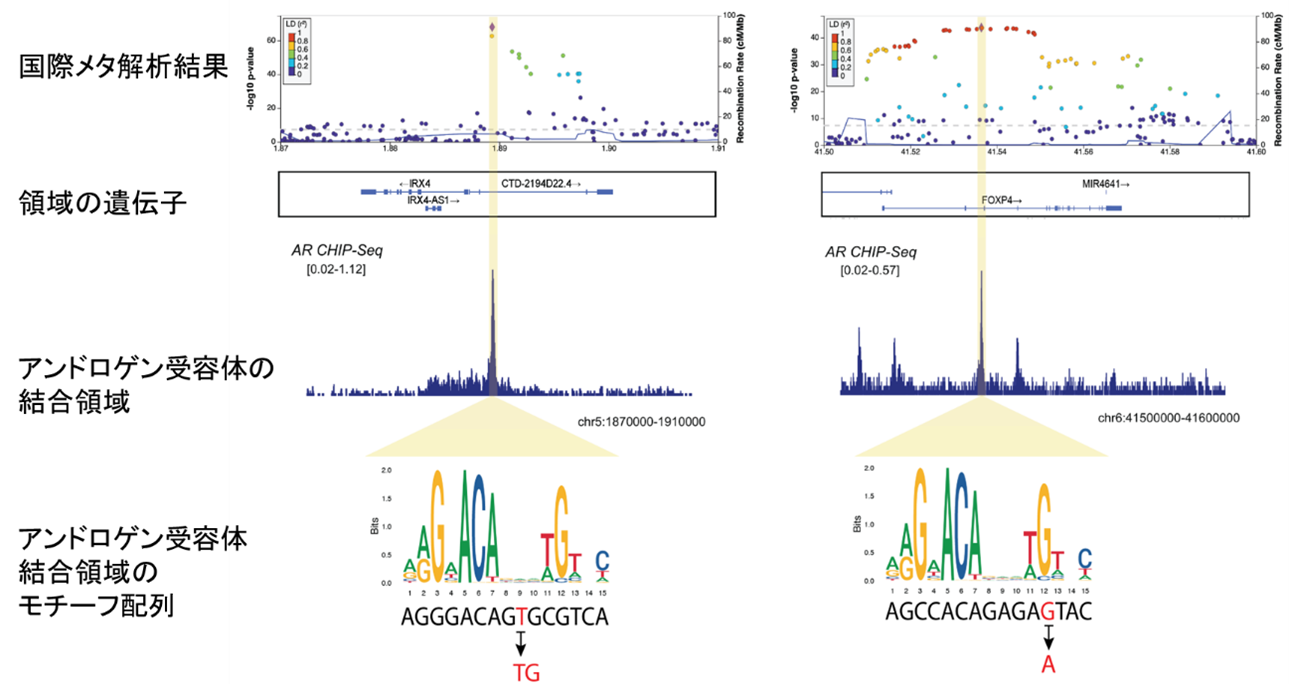
図2 国際メタ解析でアンドロゲン受容体結合領域に検出されたSNP
国際メタ解析の結果、IRX4遺伝子(左)とFOXP4遺伝子(右)上に同定されたSNPがアンドロゲン受容体結合領域のモチーフ配列(塩基配列パターン)を下矢印のように変えて、前立腺がんに関わる遺伝子発現に影響を与えていることが分かった。
続いて、ポリジェニックリスクスコア(PRS)を用いて、前立腺がんによる死亡リスクを予測できるか調べました。バイオバンク・ジャパンの参加者のうち、調査時に前立腺がんと診断されていない男性の生存調査のデータを用いて、前立腺がんによる死亡とPRSの関連をCox比例ハザード回帰モデル[13]で解析しました。その結果、PRSの下位50%に対するPRSの上位10%のハザード比[14]は3.52(95%信頼区間:1.97~6.28)でした。これは、将来のどの時点においても、PRS上位10%の人の前立腺がんによる死亡率がPRS下位50%の人の3.52倍に達することを意味しています。また、アンドロゲン受容体結合領域に着目したPRSで解析すると、ハザード比が5.57(95%信頼区間:3.25~9.54)に上昇し、関連がより強いことが分かりました(図3)。
この結果から、PRSを用いて将来的な前立腺がんの死亡リスクを予測できること、その予測には特に正常な前立腺細胞のアンドロゲン受容体結合領域が効果的であることが示されました。ここで重要なことは、今回の結果が患者個人の前立腺細胞を調べることなく、一般的なデータベースに登録されている情報を用いて得られたことです。これは、今回の結果が一般人集団に拡張できることを示しています。
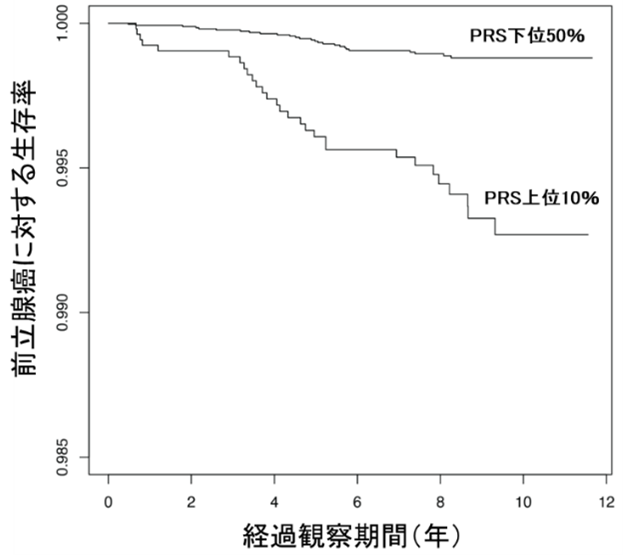
図3 Cox比例ハザード回帰モデルによる前立腺がんの死亡予測
アンドロゲン受容体結合領域に着目したポリジェニックリスクスコア(PRS)から、上位10%と下位50%との生存率の比較。横軸は初回調査時からの経過観察期間。この場合のハザード比は5.57であり、PRS上位10%の人の前立腺がんによる死亡率がPRS下位50%の人の5.57倍であることを意味する。
(注3)Conti, D. V. et al. Trans-ancestry genome-wide association meta-analysis of prostate cancer identifies new susceptibility loci and informs genetic risk prediction. Nat. Genet. 53, 65-75 (2021)
<今後の期待>
今回の研究結果から、前立腺がんの遺伝的背景には前立腺細胞におけるアンドロゲン受容体結合領域が大きく関与している可能性が示されました。また、PRSと前立腺がんによる死亡との関連をCox比例ハザード回帰モデルで解析した結果から、前立腺がんと診断されていない人における、将来の前立腺がんによる死亡リスクを予測できることが分かりました。これらのことから、本研究結果が前立腺がんの早期発見や早期治療介入につながることが期待できます。
<国際共同研究グループ>
理化学研究所 生命医科学研究センター
ゲノム解析応用研究チーム
チームリーダー 寺尾知可史
(静岡県立総合病院 免疫研究部長、静岡県立大学 特任教授)
客員研究員 伊藤修司
(島根大学医学部附属病院 整形外科 医科医員)
研究員(研究当時) 劉 暁渓(Xiaoxi Liu)
研究員 石川優樹
客員研究員 大伴直央
客員研究員 末次弘征
客員研究員 小池良直
研修生 吉野宗一郎
上級技師 冨塚耕平
ファーマコゲノミクス研究チーム
特別研究員 曳野圭子
がんゲノム研究チーム
チームリーダー 中川英刀
骨関節疾患研究チーム(研究当時)
チームリーダー(研究当時) 池川志郎
基盤技術開発研究チーム
チームリーダー 桃沢幸秀
糖尿病・代謝ゲノム疾患研究チーム(研究当時)
チームリーダー(研究当時) 堀越桃子
循環器ゲノミクス・インフォマティクス研究チーム
チームリーダー 伊藤 薫
東京大学 大学院新領域創成科学研究科 メディカル情報生命専攻
教授 鎌谷洋一郎
島根大学 医学部 整形外科学講座
教授 内尾祐司
南カリフォルニア大学(米国) 公衆衛生学
教授 クリストファー・ハイマン(Christopher A. Haiman)
教授 デビッド・コンティ(David D. Conti)
<研究支援>
本研究は、日本医療研究開発機構(AMED)革新的がん医療実用化研究事業「体細胞モザイクのがん発症および予後因子としての意義解明の開発(研究開発代表者:寺尾知可史、JP21ck0106642)」、同難治性疾患実用化研究事業「シングルセル統合ゲノミクス解析が解き明かす強皮症の病態基盤の開発(研究開発代表者:寺尾知可史、JP21ek0109555)」、同ゲノム医療実現バイオバンク利活用プログラム(ゲノム医療実現推進プラットフォーム・先端ゲノム研究開発)「先天的/後天的構造多型に着目した免疫/精神疾患病態解明に関する研究開発(研究開発代表者:寺尾知可史、JP21tm0424220)」による助成を受けて行われました。
論文情報
<タイトル>
Androgen receptor binding sites enabling genetic prediction of mortality due to prostate cancer in cancer-free subjects
<著者名>
Shuji Ito, Xiaoxi Liu, Yuki Ishikawa, David D. Conti, Nao Otomo, Zsofia Kote-Jarai, Hiroyuki Suetsugu, Rosalind A. Eeles, Yoshinao Koike, Keiko Hikino, Soichiro Yoshino, Kohei Tomizuka, Momoko Horikoshi, Kaoru Ito, Yuji Uchio, Yukihide Momozawa, Michiaki Kubo, The BioBank Japan Project, Yoichiro Kamatani, Koichi Matsuda, Christopher A. Haiman, Shiro Ikegawa, Hidewaki Nakagawa, Chikashi Terao
<雑誌>
Nature Communications
<DOI>
10.1038/s41467-023-39858-8
用語解説
[1] ゲノムワイド関連解析(GWAS)
形質(疾患の有無や量的形質)に対する遺伝的関連を知るための手法で、一塩基多型(SNP)を用いて解析するのが一般的である。形質を目的変数に、SNPの量的情報や各種共変量を説明変数にしてモデル化し、SNPの関連を評価する。GWASはGenome-Wide Association Studyの略。
[2] ポリジェニックリスクスコア(PRS)
生活習慣病やがんなどの多因子疾患においては、GWASによって発症リスクと関連する多くのSNPが発見されている。しかし、これらのSNPの遺伝的効果は小さく(1.05~2倍)、多因子疾患では、遺伝的効果の少ない多数のSNPが蓄積して疾患リスクを高めていると考えられている。PRSはGWASによって発見された病気と関連するSNPを複数個、または測定した全てのSNPの情報をスコア化した指数のことで、個人の病気の発症リスクを推定する方法の一つである。PRSはPolygenic Risk Scoreの略。
[3] 遺伝率
多くの遺伝子が関与する形質において、集団内での差異を遺伝要因と環境要因に分割したときに、遺伝要因で説明できる割合を指す。
[4] バイオバンク・ジャパン
日本人集団27万人を対象とした生体試料のバイオバンクで、東京大学医科学研究所内に設置されている。理化学研究所などが取得した約27万人のゲノムデータを保有する。オーダーメイド医療の実現プログラム、ゲノム研究バイオバンク事業などを通じて実施され、ゲノムDNAや血清サンプルを臨床情報とともに収集し、研究者へのデータ提供や分譲を行っている。
[5] アンドロゲン受容体結合領域
男性ホルモンのアンドロゲンはアンドロゲン受容体と結合して2量体を形成し、細胞核内に入り、DNAと結合する。これにより、遺伝子発現を調整し転写因子としての機能を発揮する。アンドロゲン受容体結合領域とは、その2量体が結合して下流の遺伝子発現を調節するゲノム上の標的領域(エンハンサー)のこと。
[6] 一塩基多型(SNP)
一つの遺伝的座位に、二つかそれ以上の頻度の高い異なるアレル(対立遺伝子)が存在する状態のことを遺伝的多型という。一つの塩基が他の塩基に変わる多型を一塩基多型と呼ぶ。SNPはSingle Nucleotide Polymorphismの略。
[7] LDスコア回帰法、層別化LDスコア回帰法
LDスコア回帰法はゲノム上の多くの遺伝的多型が形質に関わるという仮定(ポリジェニックモデル)の下、SNPごとに計算されるその周辺に存在するSNPとの相関情報(LDスコア)とGWASで観察された統計量の関係性を利用して、GWASの特徴をさまざまな観点で定量化できる手法。本研究では、形質間の遺伝学的背景の共有を定量化する目的で用いられた。このLDスコア回帰法を拡張したのが層別化LDスコア回帰法手法である。ゲノム上の領域を複数に分割(層別化)することで、それぞれの領域の形質に対する説明分散(貢献度)を定量化し検定できる。
[8] メタ解析
複数の独立した研究から得られた解析結果を統合するための統計学的手法。
[9] ファインマッピング
関連解析の手法の一つ。ある遺伝子座における疾患に対する真の原因SNPの数を仮定し、そのSNPが真に疾患の原因である確率を算出する手法。
[10] 転写因子
遺伝子の発現を調節するタンパク質。DNA上に存在する遺伝子の発現を制御する領域(プロモーター、エンハンサー、サイレンサーなど)に結合し、DNAを鋳型としてRNAが産生(転写)される時期や量を調節する。
[11] GREGOR
GWASで同定されたSNPがゲノム上の特定領域に集積しているかどうかを解析する手法。GREGORはGenomic Regulatory Elements and Gwas Overlap algoRithmの略。
[12] 事後確率
条件付き確率の一種で、あることが起こった場合における確率のこと。
[13] Cox比例ハザード回帰モデル
対象のイベント(例えば死亡)が発生するまでの時間を分析する、複数の説明変数に基づいた生存時間分析の手法。ハザード比を算出することができる。
[14] ハザード比
発症リスクの指標の一つで、発症までの時間も加味したリスクの上昇を表す。
関連研究室
お問い合わせ