光合成活性を持つ葉緑体を動物細胞に移植することに成功 ―光合成可能な動物細胞作製の突破口を開く―
- ヘッドライン
- 記者発表
東京大学
理化学研究所
東京理科大学
早稲田大学
科学技術振興機構(JST)
発表のポイント
◆藻類から光合成活性を持つ葉緑体を取り出し、ハムスターの培養細胞内に移植することに成功しました。移植した葉緑体は、少なくとも2日間はハムスター培養細胞内で光合成活性を保持していました。
◆今回開発した葉緑体移植法は、従来の導入機械や物理的手法を用いずに、動物細胞内に葉緑体を導入できる利点があります。
◆今回開発した葉緑体移植法は、光合成能を持たない動物細胞に一時的に光合成能を付与できる技術であり、光合成可能な動物細胞を作製するための重要な基盤技術になります。
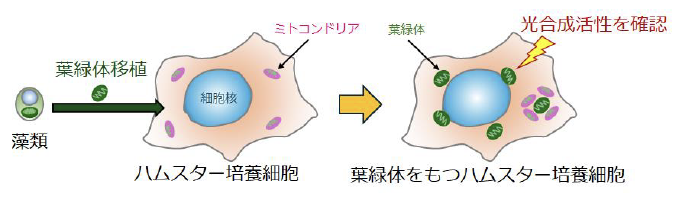
光合成活性のある葉緑体を持つ動物細胞の作製
概要
東京大学大学院新領域創成科学研究科の松永幸大教授、理化学研究所環境資源科学研究センターの豊岡公徳上級技師、東京理科大学教養教育研究院の鞆達也教授、早稲田大学教育・総合科学学術院の園池公毅教授らの共同研究グループは、藻類の葉緑体(注1)を動物培養細胞に移植し、動物培養細胞内で光合成反応を検出することに成功しました。
今回、開発した葉緑体移植法(注2)を用いて動物培養細胞に導入した葉緑体は、少なくとも2日間、動物培養細胞内で維持され、光合成活性を保持していました。
今回の葉緑体移植技術の開発により、動物細胞から酸素を発生させるとともに、排出される二酸化炭素を削減する突破口を開くことができました。葉緑体移植により、光によるクリーンエネルギーを用いて動物培養細胞の増殖を促進することが可能になり、細胞培養コストの低下や二酸化炭素排出の削減が期待できます。
本研究成果は、2024年10月31日付で国際科学雑誌『Proceedings of the Japan Academy, Series B, Physical and Biological Sciences』(略称:PJA-B)のオンライン版に掲載されました。
発表内容
葉緑体は植物細胞の中で光合成を行う細胞内小器官です。今から12〜16億年前に、光合成細菌が動物細胞に共生した結果、藻類が出現し、葉緑体が誕生したと言われています。動物細胞は葉緑体を異物として認識して消化するため、葉緑体を動物に移植することは困難でした。
本研究グル―プは、原始的な藻類・シゾン(注3)から光合成活性を持つ葉緑体を単離することに成功し、その葉緑体をハムスターから作製された培養細胞・CHO細胞(注4)に取り込ませる方法を開発しました。従来は、細いガラス管を使用して葉緑体を注入したり、物理的に細胞膜に穴をあけて取り込ませたりしていましたが、そのような従来法は使わずに、CHO細胞の貪食作用を高めることで、葉緑体をCHO細胞に取り込ませることができました。その結果、CHO細胞に最大45個の葉緑体を取り込ませることに成功しました。葉緑体を取り込んだ場合もCHO細胞の増殖は阻害されず、正常に細胞分裂を行いました。また、蛍光レーザー顕微鏡解析や超解像顕微鏡で細胞断層像を撮影した結果、取り込まれた葉緑体はCHO細胞の細胞質に存在しており、その一部は細胞核の周りを取り囲むように配置していました(図1)。
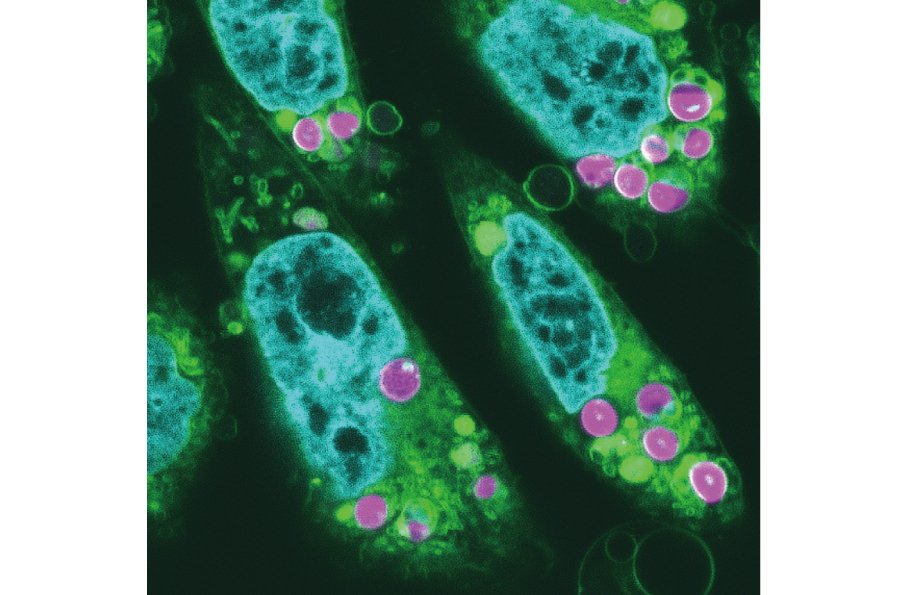
図1 藻類から移植された葉緑体を持つハムスター培養細胞(CHO細胞)
青緑は細胞核、黄緑は膜構造を持った細胞内小器官、赤紫は葉緑体を示す。中央の青い細胞核近傍や細胞質に2個から6個の赤紫色の葉緑体が存在していることが分かる。葉緑体中央部分は青い葉緑体DNAも観察される。
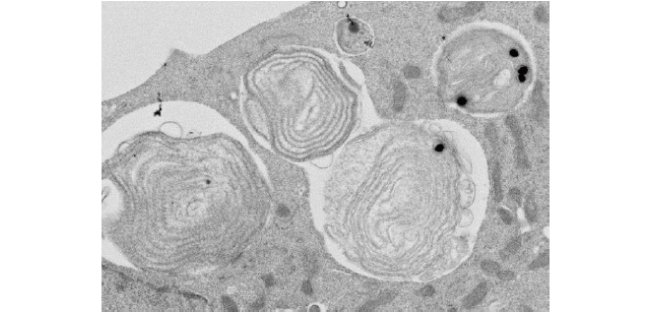
CHO細胞内の葉緑体を詳細に解析するために、電子顕微鏡を用いました。その結果、単離された葉緑体は光合成に関与する酵素が配置されるチラコイド膜の構造が維持されていることが分かりました(図2)。この葉緑体をCHO細胞に取り込ませると、葉緑体は膜に包まれた状態で細胞質に存在しており、取り込まれてから2日間は、チラコイド膜の構造が保持されていました。葉緑体がCHO細胞の細胞核の外膜に接触している様子やミトコンドリアに取り囲まれている様子も確認されました(図3、図4)。
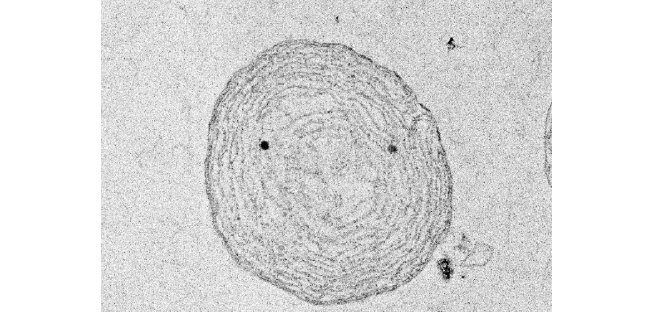
図2 シゾンから単離された葉緑体の電子顕微鏡写真
二重膜で囲まれた葉緑体内部に、光合成を行う酵素が配置されているチラコイド膜の構造が層状に保たれていることが分かる。
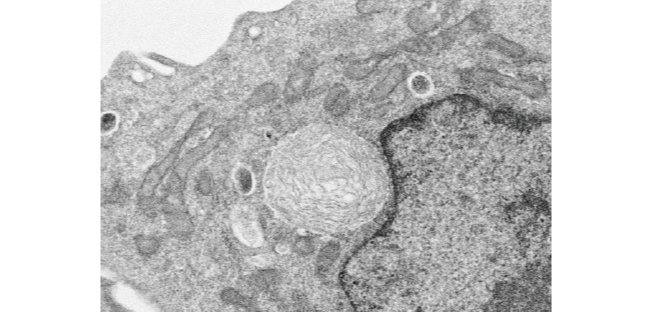
図3 葉緑体移植後、数時間後のハムスター細胞内部の電子顕微鏡写真
中央の球状の物体が、移植されたシゾンの葉緑体。シゾンの葉緑体はすぐに分解されず、葉緑体内部の膜構造を維持し光合成活性を持っていた。また葉緑体は、細胞核の外膜に接触しており、その周りをミトコンドリアが取り囲んでいた。
図4 葉緑体移植後、2日目のハムスター細胞内部の電子顕微鏡写真
4個の葉緑体が取り込まれ、2日間経過したあとのハムスター細胞内部の様子。葉緑体の内部構造は維持され光合成活性を持っていた。葉緑体内部の黒い点はストレスを受けると形成される顆粒。
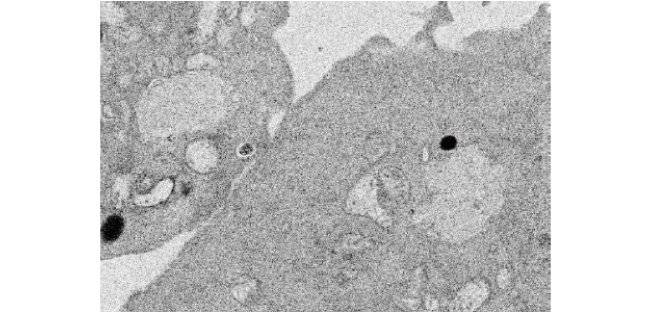
CHO細胞に取り込まれた葉緑体は、取り込み後4日目になると、チラコイド膜の構造が崩れていることが観察されました(図5)。
図5 葉緑体移植後、4日目のハムスター細胞内部の電子顕微鏡写真
4日間経過したあとのハムスター細胞内部の様子。葉緑体の内部構造のチラコイド膜構造はなくなり、葉緑体形状も崩れていることが分かる。
そこで、マイクロメートルレベルの微小領域の光合成活性を測定できる顕微イメージング・パルス変調計測法(注5)を用いて、CHO細胞内に取り込まれた葉緑体の光合成活性を測定しました。測定の結果、シゾン葉緑体はCHO細胞内に取り込まれてから2日間は光合成活性を保持していましたが、4日目に入ると、その活性は著しく減少しました。これは、チラコイド膜の構造が崩れるタイミングと一致しています。
今回開発した葉緑体移植法により、動物細胞に2日間、光合成活性を持つ葉緑体を保持させることに成功しました。さらに、移植した葉緑体が動物細胞内でより長く光合成活性を維持するための技術開発を進めています。また、今後は、移植した葉緑体から発生する酸素量や動物細胞内で固定される二酸化炭素量を、同位体標識法(注6)を用いて定量していく必要があります。
本研究グループは、植物の能力を動物に付与したプラニマル細胞(注7)の創製を目指して研究を続けており、今回の葉緑体移植法の開発は、その突破口になると期待しています。プラニマル細胞はグリーントランスフォーメーションを達成するゲームチェンジャー細胞として期待されています。今後も、二酸化炭素排出削減による持続的社会の実現を目指して、革新的なバイオテクノロジー技術を開発していきます。
発表者・研究者等情報
東京大学 大学院新領域創成科学研究科 先端生命科学専攻
青木 遼太 博士課程
乾 弥生 特任研究員
岡部 耀二 博士課程
澤田 幸希 研究当時:修士課程
森田 隼登 研究当時:修士課程
ジェノ バティスト 特任研究員
丸山 真一朗 准教授
松永 幸大 教授
理化学研究所 環境資源科学研究センター
佐藤 繭子 技師
武田 紀子 テクニカルスタッフII
豊岡 公徳 上級技師
東京理科大学 教養教育研究院教養部
鞆 達也 教授
早稲田大学 教育・総合科学学術院
園池 公毅 教授
論文情報
雑誌名:Proceedings of the Japan Academy, Series B, Physical and Biological Sciences
題 名:Incorporation of photosynthetically active algal chloroplasts in cultured mammalian cells towards photosynthesis in animals
著者名:Ryota Aoki, Yayoi Inui, Yoji Okabe, Mayuko Sato, Noriko Takeda-Kamiya, Kiminori Toyooka, Koki Sawada, Hayato Mortita, Baptiste Genot, Shinichiro Maruyama, Tatsuya Tomo, Kintake Sonoike and Sachihiro Matsunaga* *責任著者
DOI: 10.2183/pjab.100.035
URL: https://doi.org/10.2183/pjab.100.035
研究助成
本研究は、JST CREST「異種ゲノム制御による光合成作動細胞の創製」(課題番号:JPMJCR20S6)などの支援により実施されました。
用語解説
(注1)葉緑体
光合成を行う細胞内小器官。植物細胞や藻類にはあるが、動物細胞や菌類にはない。内部に、光合成を行う電子伝達系のタンパク質が配置されたチラコイド膜を持つ。光合成細菌が共生して進化してできた細胞内小器官である。
(注2)葉緑体移植法
植物や藻類から単離した葉緑体を人工的に、動物細胞や菌類に移植する技術。約50年以上前から葉緑体移植は試されてきたが、移植された葉緑体の光合成活性が確認されたことはなかった。今回、世界で初めて動物細胞内に移植された葉緑体の光合成活性を確認した。
(注3)シゾン
正式名称はシアニディオシゾン。イタリアの酸性温泉から発見された原始的な特徴を持つ紅藻。藻類中で最小の細胞サイズ、最少の遺伝子数、細胞内小器官を1個ずつしか持たないなど、光合成細菌が共生を開始して藻類が出現してから進化的に間もない特徴を持つ。一般的に、光合成細菌から由来する葉緑体ゲノムは進化するに従い、サイズが小さくなり、遺伝子数が減少していく。一方、シゾンの葉緑体ゲノムは、他の藻類や植物の約2倍の遺伝子数を保持しており、原始的な葉緑体の特徴を持つ。
(注4)CHO細胞
正式名称はChinese Hamster Ovary細胞。ハムスターの卵巣から確立された培養細胞であり、現在、抗体産生や医薬品産生に最も多用されている動物培養細胞である。
(注5)顕微イメージング・パルス変調計測法
パルス変調を用いてクロロフィル蛍光を測定することで、光化学系IIの最大量子収率や電子伝達の量子収率などを算出し、光合成活性を知ることができる。顕微鏡下で、特定の波長を微小な領域に照射し、そこから発するクロロフィル蛍光を測定する。
(注6)同位体標識法
天然生体物質に多く含まれる元素とは異なる質量数の元素を使用して、生体物質を標識して、生体内の動態を追跡する方法である。例えば、炭素のほとんどは12Cであるが、約1%の割合で13Cが存在する。12C02の代わりに、13Cで標識した13CO2を細胞内に取り込ませれば、その13CO2からどのような生体物質が細胞内で生成されるかを測定することができる。
(注7)プラニマル細胞
2018年に松永幸大教授が提唱した、植物の機能を持つ動物細胞のこと。PlantとAnimalに由来する造語Planimalから命名された。
プラニマル細胞の参考文献
Matsunaga S. Cytologia 2018年 83 巻 1 号 p. 3-6
https://www.jstage.jst.go.jp/article/cytologia/83/1/83_830103/_article/-char/ja
Morgado-Palacin L. Journal of Cell Biology 2022年 221巻 12号 e202211043.
https://rupress.org/jcb/article/221/12/e202211043/213701/Sachihiro-Matsunaga-FISHing-the-nuclear
植物と動物の融合から生じる研究と倫理の境界 - 東大TV
https://tv.he.u-tokyo.ac.jp/lecture_6028/